赛默飞与高校分测分会再续合作新篇章,赋能本土科研创新与人才培养
未来,双方将在技术创新、学术交流及人才培养等诸多领域展开广泛合作,推动本土科研能力提升及创新成果转化,赋能中国科研事业高质量发展。- 2024-04-24 08:30:56 14
- 赛默飞科研仪器实验室仪器
2022-07-13 11:40:02来源:大连化学物理研究所 阅读量:88 评论
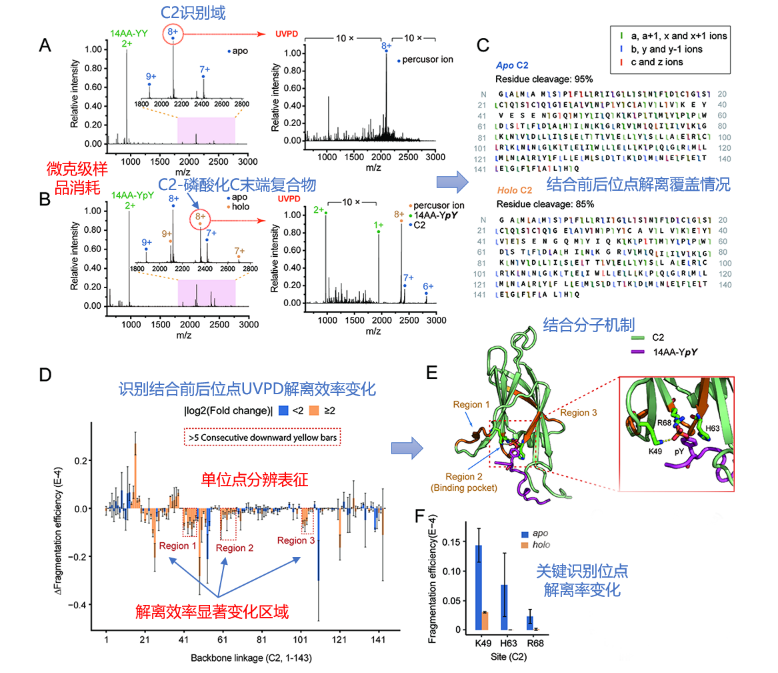
导读:近日,大连化物所生物分子结构表征新方法研究组(1822组)王方军研究员团队与南方科技大学田瑞军教授、李鹏飞副教授等人合作,利用193nm紫外激光解离—质谱装置,实现了免疫共受体CD28磷酸化胞质端与激酶PKCθ的C2结构域识别结合机制解析。
赛默飞与高校分测分会再续合作新篇章,赋能本土科研创新与人才培养
未来,双方将在技术创新、学术交流及人才培养等诸多领域展开广泛合作,推动本土科研能力提升及创新成果转化,赋能中国科研事业高质量发展。内蒙古自治区5534台大型科研仪器实现开放共享,仪器原值37.4亿元
大型科学仪器设施是用于探索未知世界、发现自然规律、实现技术变革的复杂科学研究系统,是突破科学前沿、解决经济社会发展和国家安全重大科技问题的技术基础和重要手段。
昵称 验证码 请输入正确验证码
所有评论仅代表网友意见,与本站立场无关